荧光寿命测量——频域法和时域法原理简介
荧光寿命测量——频域法和时域法原理简介
荧光寿命测量原理
荧光寿命是衡量一个荧光基团激发态通过发射光子回到基态的时间。荧光寿命的范围可以从皮秒到几百纳秒。下面列出一些常见物质的的荧光强度和荧光寿命。
|
荧光物质 |
荧光寿命[ns] |
最大激发光波长 |
最大发射光波长 |
溶剂 |
|
|
ATTO 655 |
3.6 |
655 |
690 |
水 |
|
|
吖啶橙(AcridineOrange) |
2 |
500 |
530 |
PB pH7.8 |
|
|
Alexa Fluor 488 |
4.1 |
494 |
519 |
PB pH7.4 |
|
|
Alexa Fluor 647 |
1 |
651 |
672 |
水 |
|
|
BODIPY FL |
5.7 |
502 |
510 |
乙醇 |
|
|
香豆素 |
2.5 |
460 |
505 |
乙醇 |
|
|
CY3B |
2.8 |
558 |
572 |
PBS |
|
|
CY3 |
0.3 |
548 |
562 |
PBS |
|
|
CY5 |
1 |
646 |
664 |
PBS |
|
|
荧光素 |
4 |
495 |
517 |
PB pH7.5 |
|
|
Oregon Green488 |
4.1 |
493 |
520 |
PB pH9 |
|
|
Ru(bpy)2(dcpby)[PF6]2 |
375 |
458 |
650 |
水 |
|
|
嵌二萘 |
> 100 |
341 |
376 |
水 |
|
|
吲哚菁绿 |
0.52 |
780 |
820 |
水 |
|
|
罗丹明B |
1.68 |
562 |
583 |
PB pH7.8 |
|
|
表1. 常用的荧光染料和荧光寿命。 |
|||||
一个处于激发态的物质,当其返回基态,光子数衰减到原来的1/e,或36.8%,所经历的时间即为荧光寿命:

如荧光强度衰减图(图1)所示,荧光寿命t是荧光强度衰减到原来1/e的时间。荧光强度与衰减时间的函数:
![]()
I(t)是指时间为t时的荧光强度,α是一个标准系数,τ是时间寿命。
了解荧光寿命的基本理论对于理解利用荧光寿命进行定量分析的方法是非常重要的。
目前测定荧光强度的方法主要有“时域法”和“频域法”两种。
时域法
所谓时域法,就是一定发射强度的短脉冲光照射样品,并记录时间。短脉冲光以前使用的是闪光灯,分辨率可以达到几个纳秒。现在用的是激光光源,分辨率可以达到皮秒或更短。

图1。表示的短脉冲光激发下的荧光荧光的衰减图。
如果用场波长的激发光激发,荧光强度和寿命是一个单指数关系,这时寿命可以也可以用曲线的斜率直接测定。如果寿命时间和激发脉冲光的分辨率比较接近,计算时间寿命必须去除“堆积”效应。
我们正努力数学的方法研究“反堆积”对激发脉冲光的影响。可以看到的荧光衰减的曲线形状(见许多章节[ 2 ])。目前,随着告诉脉冲激光的出现,这些“反堆积”过程对于大多数寿命测量已经变得不那么重要了,尽管它们仍然存在。测量时,可以使用与寿命时间相当的光脉冲。
频域法
频域法的原理是:
![]()
E(t)and E0分别是时间在t和0的荧光强度,ME是调制系数,![]()
是光束的调制频率,图二显示的是荧光强度和荧光寿命时间的关系。

图2 蓝色是激发光谱,红色是荧光光谱,可以显示它相对于激发光谱的相位偏移
荧光多相位解频的公式如下:

相位移:![]()
这两种关系都与衰变时间τ有关,用仪器测量解调系数和相位,在不同的调制频率偏移(通常为15-20),数据对理论模型进行拟合。因此利用相移和相对调制可以确定全程相位τP和全程调制τM.,如果荧光衰减是单指数,然后τP和τM将取决于调制频率。
![]()
τP和τM和的差异主要是频率形式,即分析方法基础上的差异,包括寿命和振幅。
必须注意区分总强度f从到α的影响度,即之前说的时间域。这两个术语之间的关系是由:

其中J代表所有成分的总和,α指前因子,τ是这些物质的寿命。
分析
多频相位和调制数据通常用非线性最小二乘法进行分析,其中实际相位和调制率数据(不是寿命值)适合于单个或多个指数衰减的不同模型。
拟合的质量是通过减少的卡方值判断

除了使用离散指数衰减模型进行衰减分析外,还可以选择将数据拟合到分布模型。在这种情况下,假定发射态的激发态衰减特性实际上导致了大量寿命分量。下面是一个典型的寿命分布图。单色氨酸含蛋白-人血清白蛋白。
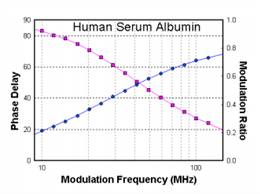

图三所示为频率响应曲线(相位和调制率VS 调制频率)。人血清蛋白HAS在激发光源LED300nm,下,使用长通320nm滤片在20℃收集发射信号。使用洛伦兹变换拟合数据(中心点5.4ns,宽度2.9ns,分布98%)和另一个离散拟合数据部分(t=0.51ns,分布0.02%)。这里显示的分布是Lorentzian,而是取决于系统的衰减动力学,不同类型的分布,如高斯,或不对称分布(普朗克),可以利用。本文描述了寿命分析的方法。
应用
荧光寿命的测定
荧光寿命是表征荧光物质和荧光性质的重要手段。蛋白质的生物物理研究,例如特定的氨基酸残基之间的距离由福斯特共振能量转移(FRET)。此参数主要不受内部过滤效果,静态淬火和荧光基团的浓度变化的影响。因此有利于临床和高通量筛选(HTS)应用于鉴别生物样品高背景荧光的应用。
另外,这个参数在多路复用方面提供了更多的优势。区分两个荧光基团的能力,具有相似的光谱但不同的寿命是另一种增加测量参数的方法,例如[ 5 ]。可以利用几种机制来开发基于寿命的分析方法。有简单的结合分析,在结合2部分组成(一个被荧光标记)是伴随着参数的变化。另一种情况是猝灭释放型分析,淬灭的物质有低但有限的荧光,但最初存在大量过剩。如果荧光化合物被释放(与互补的DNA链结合)(分子信标)或酶促反应)系统的寿命增加。荧光共振能量转移分析中能量传递效率的测量方法,为避免供体和受体之间的光谱重叠问题,可以采用非荧光受体。
Books and Book Chapters related to Fluorescence Lifetime
2. Valeur, B. (2002). Molecular Fluorescence. Wiley-VCH Publishers.
3. Herman B. (1998). Fluorescence Microscopy, 2nd Edition, Springer-Verlag, New York.



